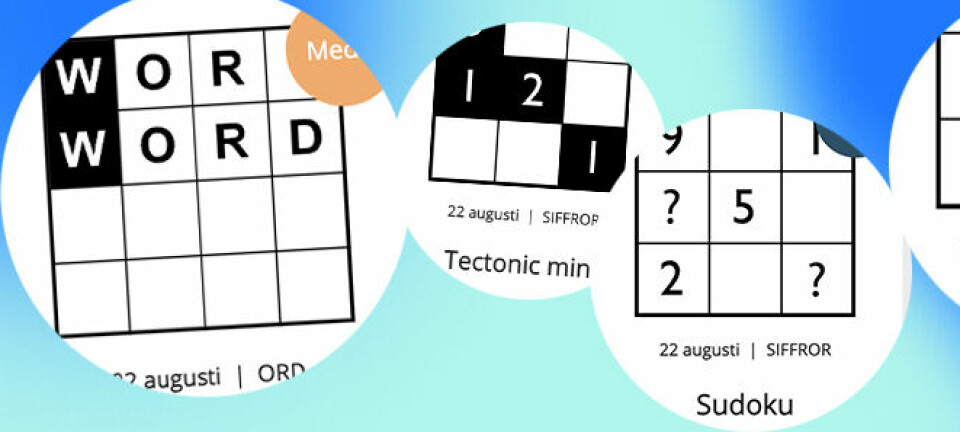
INNOVATION
Nobelpristagarna i kemi 2024: David Baker, Demis Hassabis och John M Jumper presenteras av Johan Åqvist (ledamot av Nobelkommittén för kemi), Hans Ellegren (Vetenskapsakademiens ständige sekreterare) och Heiner Linke (ordförande för Nobelkommittén för kemi)
Christine Olsson/TT
Tre delar Nobelpris i kemi – knäckt koden för proteinernas strukturer
Forskarna David Baker, Demis Hassabis och John Jumper har knäckt koder för strukturen i proteiner, ”livets kemiska multiverktyg”. Nu tilldelas de Nobelpriset i kemi av Vetenskapsakademin.
– Jag känner mig djupt hedrad, säger David Baker som är med på pressträffen via telelänk.
Han prisas för konststycket att designa nya proteiner som kan fungera som läkemedel, vaccin, nanomaterial och minimala sensorer. Den 62-årige amerikanen berättar att han låg och sov när telefonen ringde och beskedet nådde honom.
– Min fru skrek så högt att jag inte riktigt hörde vad personen sa.
Proteiner brukar kallas för livets byggstenar och att förstå deras strukturer ger avgörande kunskap om allt levande. Det handlar om bland kroppens funktioner, sjukdomar och utveckling av läkemedel.
En annan av årets kemipristagare, britten Demis Hassabis, belönas tillsammans med amerikanen John Jumper för sina arbeten med att ta fram proteinstrukturer med hjälp av AI.
– Jag var verkligen chockad och jag blev liksom tom i några minuter, säger Hassabis till TT.
3D-strukturer
48-åringen Demis Hassabis är medgrundare och vd för Googles Deepmind-avdelning där även 39-åringen John Jumper är verksam. För fyra år sedan presenterade de AI-modellen kallad AlphaFold2. Den ledde till ett väldigt efterlängtat genombrott i arbetet med att förutsäga proteiners strukturer i 3D, något som gäckat forskare sedan 1970-talet.
Med hjälp av den har de kunnat förutspå strukturen för i princip alla de 200 miljoner proteiner som forskare känner till. Sedan genombrottet har AlphaFold2 använts av mer än två miljoner personer från 190 länder. Bland väldigt mycket annat, kan forskare bättre förstå antibiotikaresistens och skapa bilder av enzymer som kan bryta ner plast.
AI gånger två
Det blir andra dagen i rad som artificiell intelligens är grunden i Nobelpristagarnas forskning. Vetenskapsakademin får frågan om de tog hänsyn till att gårdagens fysikpris gick till det bredare fältet neurala nätverk och att även dagens kemipris kan klassas in där.
– Varje Nobelpris måste kunna stå för sig självt, säger Heiner Linke, ordförande i Nobelkommittén för kemi.
Utan proteiner hade livet inte existerat. Att vi nu kan förutsäga hur proteiner får sin struktur och designa egna varianter gör mänskligheten den största nytta.
FAKTA
Alphafold och problemet med proteinveckning
Under 2020 demonstrerade brittiska Deepmind (numera Google Deepmind) att Alphafold, deras ai-system, med stor pricksäkerhet kan förutsäga proteiners 3d-struktur. Fram till det ögonblicket var biokemister och molekylärbiologer övertygade om att ett sådant genombrott låg årtionden in i framtiden.
Bara två år senare, 2022, meddelade Deepmind att Alphafold kan förutsäga strukturen på över 200 miljoner proteiner. Vilket råkar vara i princip samtliga proteiner – i människor, djur, växter och bakterier – som vetenskapen känner till.
Proteiner består av olika kombinationer av 20 aminosyror. Först är aminosyrorna trädda ungefär som pärlor på ett band. Därpå kröker sig bandet, veckas, skruvas och vrids till en tredimensionell struktur.
Antalet former ett protein kan anta är stort. Att genomsöka alla möjliga konfigurationer för att hitta den mest energieffektiva och korrekta veckningen av ett protein skulle ta längre tid än universum existerat, även om samplingshastigheten sker på en miljarddel av en sekund. Ändå veckar sig proteiner på bara millisekunder. Det här kallas Levinthals paradox, uppkallat efter den amerikanske molekylärbiologen Cyrus Levinthal.
Före Alphafold fick forskare använda röntgenkristallografi och andra mycket dyra, komplicerade och tidskrävande metoder för att försöka utröna proteiners 3d-struktur. På 70 år hade forskare lyckats lista ut formen på omkring 190 000 proteiner. Det tog Alphafold två år att addera de omkring 200 miljoner som återstod.
Strukturen av ett protein bestämmer dess funktion. Kan man förutspå strukturen blir det enklare att begripa hur proteinet interagerar med sin omgivning. Enklare att påverka det, kontrollera det och modifiera det.
– Det här kommer att förändra biomedicinsk vetenskap och biologisk ingenjörskonst. Det kommer att förändra allt, har Andrei Lupas, evolutionsbiolog vid Max Planck-institutet i Tyskland, sagt.